Le 21 septembre 2017, j'ai assisté à la conférence « Poisons versus remèdes », du cycle de conférence « Santé en questions » organisé par l'Inserm (Institut national de la santé et de la recherche médicale). Ça tombe bien, j'adore tout ce qui se rapporte au biomimétisme : étudier les richesses de la nature pour développer des technologies avancées, ici des médicaments.
Avec Eric Lingueglia, directeur de recherche à l'Inserm, Pascal Luccioni, maître de conférences en littérature grecque et romaine, Xavier Cachet, pharmacien et maître de conférence en pharmacognosie, Marc Litaudon, docteur en pharmacie et ingénieur de recherche au CNRS.
Histoires antiques
Abonnez-vous à notre infolettre!
Pour ne rien rater de l'actualité scientifique et tout savoir sur nos efforts pour lutter contre les fausses nouvelles et la désinformation!
Les poisons exercent une forte fascination sur nous à travers l'histoire, comme avec le mythe des Borgia ou la figure de Mithridate, un roi ayant vécu lors de l'Antiquité hellénistique au premier siècle avant Jésus-Christ. Selon la légende, le monarque expérimentait des poisons sur des personnes condamnées à mort et s'en administrait de faibles doses afin de s'immuniser contre leurs effets. D'où le verbe mithridatiser, s'immuniser contre un poison par une accoutumance progressive, ainsi que le nom de mithridatisation.
S'en inspirant, Andromacos, médecin de Néron, premier siècle après Jésus-Christ, mit au point la thériaque. Présent dans la pharmacopée française jusqu'en 1884, le remède et ses évolutions visaient à guérir l'ensemble des maladies, liées à l'idée d'empoisonnement. Comme la vipère était considérée comme venimeuse dans l'ensemble de son corps et pas seulement à travers ses glandes à venin, elle en constituait l'un des ingrédients. Pas sympathique pour les vipères. Toujours au premier siècle après Jésus-Christ, l'historien Pline l'Ancien décrivit plus de sept mille poisons.
Vers une médecine de haute technologie
Avec le développement de la médecine dite moderne, les connaissances assemblées dans les médecines dites traditionnelles ont été perdues, puis de nouveau explorées à travers des médecines dites alternatives comme les phytothérapies. Notre médecine actuelle s'est construite sur une rationalisation qui s'est malheureusement accompagnée d'un réductionnisme à l'échelle des seules molécules, réductionnisme qui se retrouve par ailleurs dans le sens où la médecine n'est pas qu'une question de médicaments mais aussi de relations humaines.
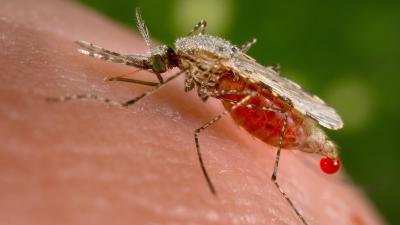
Sortir de la culture du médicament à basse technologie peut se réaliser sans tomber dans le sophisme de l'appel à la nature, « Le naturel n'étant pas dénué de toxicité » comme il est toujours nécessaire de le rappeler. Un exemple : en analysant le cas du paludisme, des ethnopharmacologues ont développé une association entre la quinine et l'armoise chinoise, une plante qui ne soigne pas en tant que telle mais en augmentent la sensibilité à la quinine du parasite responsable de la maladie. La vision d'ensemble permet de profiter des effets complexes que provoquent les molécules les unes sur les autres, c'est ici un « effet cocktail » vertueux.
Récupérer les molécules d'intérêt
Toute molécule peut être un poison ou un remède et, dans le cas de la plupart des molécules biologiques, « C'est la dose qui fait le poison ». Issues des processus continus de l'évolution, les molécules des végétaux présentent des structures et des fonctions complexes, susceptibles de trouver des applications en santé. La chimie élaborée d'un arbre peut en effet produire jusqu'à deux mille molécules différentes pour la communication ou la défense, la fuite face notamment à un herbivore n'étant pas envisageable. Un système tel que l'Extractothèque de l'Institut de chimie des substances naturelles, qui rassemble plus de 14 000 extraits préparés à partir de 6 500 plantes, permet d'expérimenter l'effet de composés afin de détecter des molécules d'intérêt.
L'étude de molécules biologiques pose la question des différences de ressources des communautés humaines. Par exemple, en Nouvelle-Calédonie, la toxicité du sol a résulté en une forte pression sur les végétaux au cours de leur évolution, d'où une grande diversité biologique qui se traduit par une grande diversité biochimique. La problématique est la même pour étudier d'éventuels poisons sous-marins. La France, par exemple, pays présent au bord de tous les océans et comportant une grande distance de côte, pourrait développer une économie de la mer ambitieuse afin de participer aux avancées scientifiques de la pharmacopée de demain.
Du mamba à la mambalgine
Les animaux aussi sont une source de potentielles molécules d'intérêt, l'exemple classique étant celui du mamba noir. Le venin brut de ce serpent africain est mortel, mais une technique de fractionnement permet d'isoler un composé parmi une centaine. Le peptide, nommé mambalgine, présente des effets analgésiques comparables en intensité à ceux de la morphine, à partir de mécanismes différents donc sans ses effets secondaires. Avec d'autres effets secondaires pour être précis car « Il n'y a pas de médicaments sans effet secondaire », mais la diversité des molécules disponibles est la clé pour développer des remèdes adaptés à chacun·e.
Le venin a une action neurotoxique, c'est-à-dire que les molécules qui le composent ciblent la transmission de l'influx nerveux le long des neurones. Pourquoi ce venin contient-il un peptide analgésique ? Selon l'hypothèse évolutive de l'adaptation, la mambalgine aide le serpent à foudroyer ses proies. Cependant, les réflexions ne peuvent pas exclure l'hypothèse évolutive du bricolage selon laquelle l'activité combinatoire des enzymes a produit ce peptide, qui agit sur les circuits nerveux sans bénéfice particulier pour le mamba. Toujours est-il qu'une fois la molécule identifiée et les mécanismes de sa synthèse compris, la molécule peut être synthétisée artificiellement sans plus aller déranger les mambas afin d'enrichir nos pharmacopées.
En termes de forme, l'organisation en duplex entre la Cité des sciences et de l'industrie de Paris et le Musée des confluences de Lyon rendait très bien. À l'inverse, la parité était inexistante et le mur de tweets #ConfsanT peu dynamique (allez, d'ici la prochaine, je réussis à me connecter à Twitter depuis mon téléphone !).
Deux autres conférences sur la santé sont programmées, une en octobre en duplex avec Montbéliard sur les résistances aux antibiotiques et une en novembre en duplex avec Marseille sur la musicothérapie :-D
N’hésitez pas à partager ce billet de blogue, ainsi qu’à le commenter pour partager vos avis et vos réflexions sur ces sujets.