Les vaccins sont les produits les plus difficiles à produire de l’industrie pharmaceutique. Ils sont fragiles et peuvent facilement être dégradés par la température ou la lumière. Et ils demandent un contrôle de la qualité serré. Une fois un vaccin homologué par les autorités, sa production prend généralement de 6 à 36 mois, contrairement à quelques semaines à 6 mois pour un médicament chimique. Voici les deux grandes étapes de leur production de masse : la production de la substance active et la production pharmaceutique.
Ceci est le second d'une série de trois articles sur les vaccins. Pour lire les deux autres, c'est par ici:
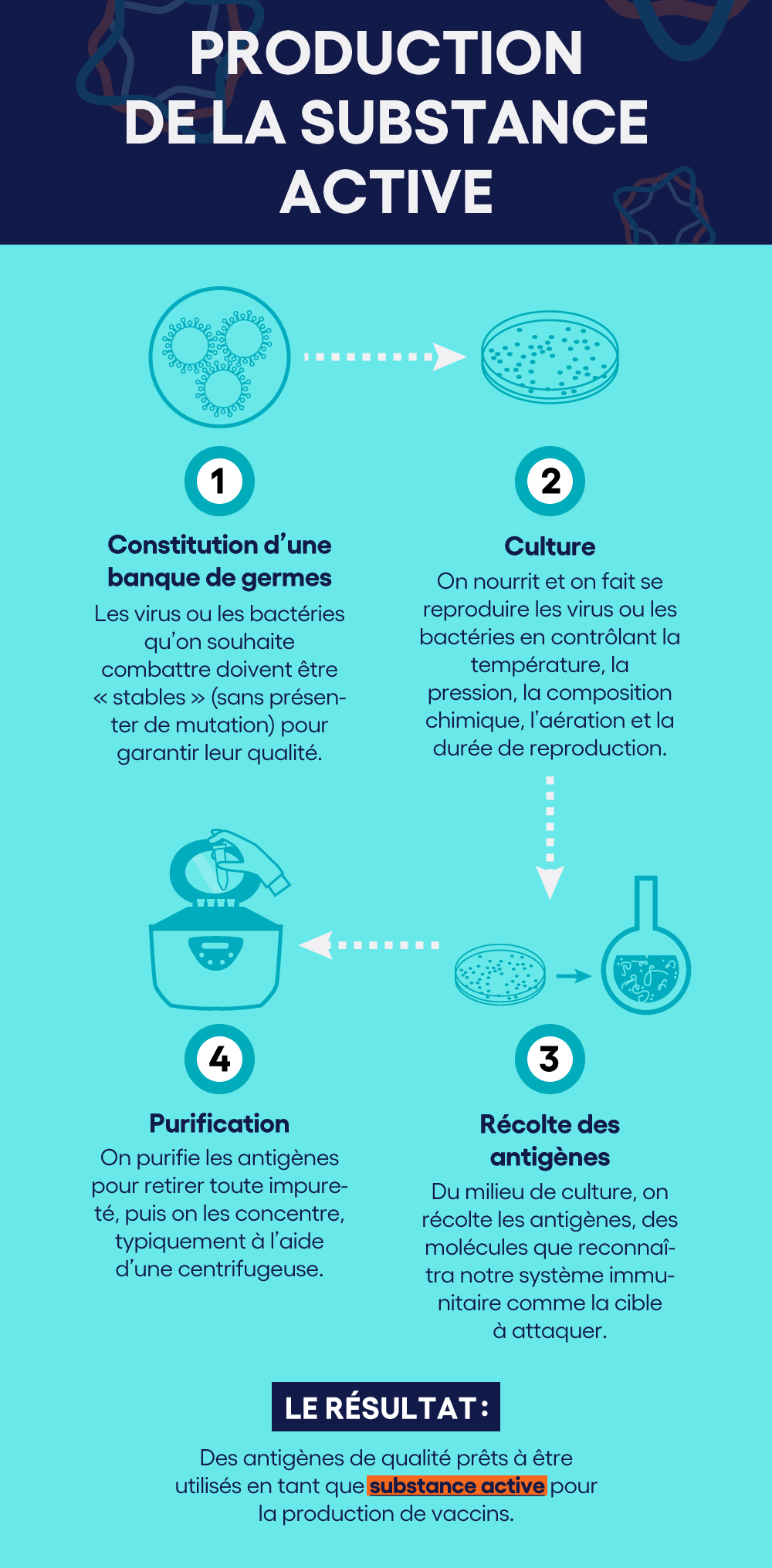
1. La production de la substance active
Abonnez-vous à notre infolettre!
Pour ne rien rater de l'actualité scientifique et tout savoir sur nos efforts pour lutter contre les fausses nouvelles et la désinformation!
Tout d'abord, on doit constituer une banque de germes, c’est-à-dire une « réserve » du virus ou de la bactérie qu’on souhaite combattre. Il doit s’agir de versions dites « stables », qui ne présentent aucune mutation pour en garantir la qualité.
On choisit ensuite un microorganisme producteur. C’est son cycle de reproduction qui permettra la culture à grande échelle de la substance active du vaccin.
Dans des milieux de culture où on nourrit les virus ou les bactéries, on doit contrôler la température, la pression, la composition chimique, l’aération et la durée de reproduction, ainsi que mesurer le nombre de germes. On doit aussi contrôler la qualité, pour éviter de se retrouver avec des contaminations par agents étrangers (ou agents adventices). On appelle cette étape « sécurité virale ».
Les milieux de culture diffèrent selon le type de vaccin. Les plus connus sont les œufs de poule (grippe, fièvre jaune). D’autres vaccins sont produits dans un milieu cellulaire. Une nouvelle approche fait appel à des plantes (utilisée par la société Medicago, de Québec).
Ces milieux de culture servent à produire des antigènes, c’est-à-dire ces molécules que reconnaîtra notre système immunitaire comme la cible à attaquer. Les antigènes sont donc récoltés pour être purifiés et concentrés. L’étape de concentration est souvent physique et non chimique : avec, par exemple, des centrifugeuses.
Certains vaccins impliquent qu’on doive rendre les germes inoffensifs (on parle d’inactiver le pouvoir pathogène des germes). Le vaccin qui les contient devra toutefois être encore capable de déclencher une réaction immunitaire, mais sans déclencher la maladie. On parle de vaccins inertes ou inactivés. Cette étape se fait avec de la chaleur ou des agents chimiques, comme le formaldéhyde ou la bêtapropriolactone.
Plusieurs vaccins protègent contre plusieurs germes occasionnant une même maladie ou contre plusieurs maladies à la fois (au Québec, le plus connu est le DCaT-HB-VPI-Hib administré aux enfants de six ans, qui protège contre la diphtérie, la coqueluche, le tétanos, l’hépatite B, la polio et les infections à Hib). On appelle ces protections « valences ». Un vaccin peut donc comporter comportera une ou plusieurs valences. On ignore pour l’instant s’il sera possible qu’un vaccin contre l’actuel coronavirus protège contre d’autres coronavirus.
2. La production pharmaceutique
Pour obtenir un produit fini à grande échelle, il faut rassembler les matières premières et tester à nouveau leur qualité. Chaque composant répond à des normes précises de qualité établies par l’Organisation mondiale de la santé (OMS), qui visent à minimiser les risques de contamination et à assurer une croissance optimale des microorganismes. Certains composants d’origine animale ou végétale nécessitent une attention particulière, car leur composition chimique complexe peut induire des différences entre chaque lot et affecter le rendement final du vaccin.
On ajoute ensuite, lorsque c’est possible, adjuvants et stabilisants. Les adjuvants, ou immunostimulants servent à stimuler davantage la réaction du système immunitaire. Ils visent à produire notamment plus de cytokines, ces protéines clefs de notre réponse immunitaire. Les nouveaux adjuvants permettent d’augmenter de manière spectaculaire l’efficacité des vaccins. Un petit nombre des vaccins candidats recensés par le New York Times comportent des adjuvants. Les stabilisants permettent la conservation et le transport du vaccin (eau stérile ou salée), d’éviter la multiplication rapide de bactéries et d’éviter que le vaccin ne s’autodétruise ou ne colle aux parois des contenants de transport.
Suit l’étape de mise en fiole ou en seringue. Ces contenants doivent être stériles. Le procédé de remplissage ne doit pas exposer le vaccin à des contaminants. Certains vaccins subissent un procédé de lyophilisation (on retire l’eau pour transformer le vaccin en poudre) pour améliorer leur conservation et leur stabilité.
La dernière étape est celle du conditionnement : on étiquette flacons ou seringues et on les met en boîtes dûment identifiées par lots pour garantir l’homogénéisation de la fabrication des doses et faciliter traçage et rappels (si nécessaire). Normalement, un lot comprend 50 000 à 1 000 000 de doses.
Avant d’expédier le vaccin, les lots sont vérifiés par la société pharmaceutique et les autorités de santé, une étape qui dure habituellement 60 jours. Chaque lot doit être « libéré » par la société pharmaceutique et les autorités de santé, qui émettent un certificat en conséquence. Le certificat encadre la commercialisation.
La commercialisation
Les lots sont livrés à des distributeurs, qui les acheminent là où les vaccins seront inoculés (hôpitaux, cliniques, pharmacies, centres de vaccination, agences internationales de santé, etc.). Durant le transport et la conservation en entrepôt ou dans les sites d’inoculation, les vaccins doivent être conservés dans des conditions favorables de température et de luminosité. Ils ne doivent pas être exposés au soleil ni être congelés. Normalement, ils doivent être conservés au frais depuis la production en usine jusqu’à l’inoculation, selon un procédé bien connu en alimentation (ligne ou chaîne de froid).
Il se produit parfois des ruptures de stocks de vaccins, principalement dues à une capacité de production insuffisante, des difficultés durant la production (composants ou usine qui ne respectent pas les normes) ou des défauts de qualité, qui peuvent conduire à un rappel de lots de vaccins déjà sur le marché.
La COVID-19 pourrait présenter des caractéristiques inédites: avec le grand nombre de vaccins actuellement testés (plus de 200 à la mi-octobre), il est très peu probable qu’il n’y en ait qu’un seul qui soit approuvé, produit et commercialisé. On pourrait donc se retrouver avec des vaccins différents d’un pays à l’autre, en fonction des ententes passées entre les gouvernements et les compagnies. Par ailleurs, compte tenu de la vitesse inhabituelle à laquelle les étapes ont été franchies cet été (voir notre autre texte : Les étapes de production), il est également possible que le premier vaccin à avoir franchi toutes les étapes n’ait qu’une efficacité limitée et qu’il faille attendre plus tard en 2021 pour en voir arriver un qui soit plus efficace.