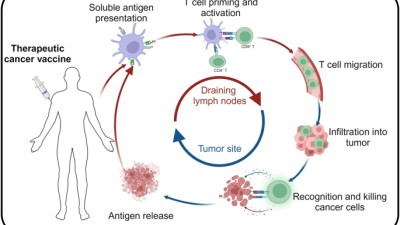
En cette ère de rectitude alimentaire, le dicton Manger une pomme par jour éloigne le médecin pour toujours n’aura jamais eu autant de portée. Nous sommes désormais bien informés sur l’importance d’une saine alimentation pour prévenir nombre de maladies chroniques, dont les diverses formes d’arthrite ou de cancer. La recherche démontre que celles-ci ont souvent un élément en commun : l’inflammation chronique, qui serait à éviter comme la peste. Nous aimerions tous savoir comment nous en prémunir ou freiner sa progression. La solution passerait-elle par un geste aussi simple que celui de manger certains aliments et d’en proscrire d’autres ? Entrevue avec la nutritionniste Roxanne Papineau.
Quelles sont les causes de l’inflammation chronique ?
Plusieurs causes coexistent. Les maladies inflammatoires chroniques sont multiples : toutes les formes d’arthrite, les maladies inflammatoires de l’intestin, le psoriasis et plusieurs maladies neurodégénératives qui ont une composante inflammatoire. Dans ces maladies, il y a toujours une composante génétique. Par exemple, on retrouve des modifications dans certains gènes qui sont communes aux individus présentant une maladie inflammatoire donnée. Les gènes peuvent donc prédisposer à avoir une maladie inflammatoire. À cela s’ajoute toujours une composante environnementale, qui inclut entre autres l’alimentation, le stress et certains médicaments. Autrement dit, ça prend toujours plusieurs ingrédients pour faire un gâteau.
Abonnez-vous à notre infolettre!
Pour ne rien rater de l'actualité scientifique et tout savoir sur nos efforts pour lutter contre les fausses nouvelles et la désinformation!
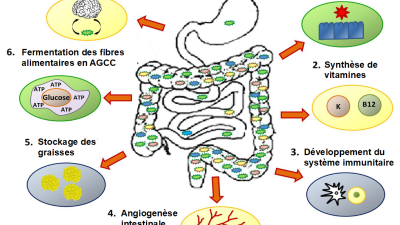
Dans le cas des maladies inflammatoires, on s’intéresse à ce qui est commun aux personnes qui vont les développer. Personnellement, je m’intéresse particulièrement à l’inflammation chronique et à l’implication dans celle-ci de l’intestin et du microbiote, car on estime que 70 % des cellules immunitaires dans le corps sont produites dans l’intestin. Pourquoi considère-t-on que l’intestin est autant impliqué dans l’inflammation ? Quand on compare le microbiote d’une personne avec une maladie inflammatoire comme le psoriasis ou une arthrite avec celui d’une personne qui n’a pas de maladie inflammatoire, on se rend compte que leurs microbiotes sont différents. Comment ? Le microbiote de la personne qui souffre d’une maladie inflammatoire a moins de diversité dans les bactéries présentes. Il a aussi des bactéries qui sont plus ou moins présentes, et on sait maintenant que ces bactéries dans l’intestin sécrètent des molécules qui sont soit pro-inflammatoires, soit anti-inflammatoires. Tout l’environnement intestinal est important, autant la couche de mucus que les cellules épithéliales de la membrane de l’intestin.
L’intestin des personnes atteintes d’une ou plusieurs maladies inflammatoires démontre souvent une dysbiose intestinale, c’est-à-dire que les bactéries présentes ne sont pas optimales en quantité ou en diversité. Il peut aussi présenter une hyperméabilité intestinale qui prédispose à des réactions inflammatoires systémiques.
Plusieurs causes peuvent être impliquées dans une dysbiose, dont les antibiotiques pris durant l’enfance, qui ont des effets sur le développement du microbiote. On constate que les enfants qui ont été traités par antibiotiques à répétition ont plus de chances de présenter une dysbiose, qui pourrait prédisposer à certaines maladies inflammatoires.
Aussi, souvent le stress est un déclencheur d’une maladie inflammatoire, car le lien est très fort entre l’intestin et le cerveau. Et parfois, une maladie inflammatoire, comme l’arthrite, se développe à la suite d’une infection qui perturbe le microbiote de façon permanente. Donc, le microbiote n’est pas le seul à être impliqué dans les maladies inflammatoires, mais nous pouvons établir plusieurs liens entre lui et elles.
Les causes étant multifactorielles, à quel degré l’alimentation peut-elle faire une différence ?
Une des lacunes dans les études en nutrition, c’est qu’on ne peut pas contrôler les paramètres. Par exemple, on ne peut pas contrôler la consommation d’oméga-3 chez des sujets pendant 15 ans et voir les effets sur la santé. Il y aura toujours d’autres facteurs confondants qui influenceront les résultats, comme des médicaments, des aliments ou l’environnement. Par contre, on est capable, avec les études épidémiologiques, de déceler certains schémas alimentaires. Par exemple, les gens qui ont tel type d’alimentation ont moins tendance à développer telle maladie comparativement à ceux qui ont un autre type d’alimentation. Et dans les maladies inflammatoires, certains aliments néfastes semblent plus souvent impliqués : la viande rouge et les viandes transformées.
Pourquoi ? Lorsqu’on creuse la question, on se rend compte que ces aliments ont des effets sur le microbiote. Lorsque l’intestin digère ces protéines animales, les bactéries protéolytiques produisent des déchets pro-inflammatoires. Ceux-ci sont normalement éliminés dans les selles, mais si on consomme ces aliments en trop grande quantité, l’accumulation de déchets crée un milieu inflammatoire néfaste pour la santé. Donc, si on mange trop de protéines, à long terme, on favorise la croissance de bactéries protéolytiques, au détriment d’autres bactéries plus favorables à la santé du microbiote.
À l’inverse, lorsqu’on consomme beaucoup de fibres, les bactéries de type saccharolytique seront capables de digérer ces fibres et de les transformer en acides gras à chaînes courtes. Ceux-ci sont très importants pour la santé de l’intestin, car ils ont un effet bénéfique sur la muqueuse intestinale et ils produisent des cellules T régulatrices, qui elles réduisent l’inflammation. Donc, si notre alimentation est riche en protéines et faible en fibres, l’équilibre intestinal est perturbé et le milieu devient propice à l’inflammation.
Plusieurs nutriments autres que les fibres peuvent avoir un effet modeste sur le risque ou le contrôle de l’inflammation. Parmi ceux-ci, les antioxydants qu’on retrouve dans les petits fruits jouent un rôle prébiotique qui favorise la croissance des bonnes bactéries. Il y a aussi les bons gras, comme les oméga-3 et les oméga-9, qu’on retrouve dans les poissons et l’huile d’olive et qui diminuent l’inflammation, contrairement aux gras saturés de la viande et des fromages, dont les effets sont moins favorables.
Lorsqu’on combine tous ces éléments, on peut déterminer ce qui constitue une alimentation idéale avec des propriétés anti-inflammatoires. Ce n’est pas une panacée, bien sûr. En revanche, toutes les études épidémiologiques constatent les effets protecteurs d’une alimentation végétale, riche en fibres et moins transformée, et les effets plus délétères de l’alimentation nord-américaine (la Western Diet), qui est plus riche en gras, en protéines et en aliments transformés.
Si certains aliments aident à réduire les effets d’une maladie inflammatoire, pourraient-ils la prévenir ?
Aucune étude ne pourra vérifier cela. En revanche, pour une personne qui aurait une prédisposition génétique, le fait de bien manger lui permet de mettre toutes les chances de son côté. Effectivement, adopter une alimentation plus anti-inflammatoire aide à avoir un microbiote le plus sain possible. Et lorsqu’une personne a déjà une maladie, avec un microbiote déjà perturbé, une telle alimentation peut permettre d’améliorer la situation. L’idée est de mettre l’accent sur ce qu’on a de bon, soit de favoriser la croissance de nos bonnes bactéries déjà présentes dans l’intestin.
Le microbiote propre à chaque individu est en grande partie déterminé avant l’âge de 4-5 ans. Toutefois, il peut être modulé par l’alimentation, mais les bonnes habitudes doivent être gardées à long terme. Autrement, puisque le microbiote est résilient, il retrouvera son état de base dès les bonnes habitudes cessées. Ça implique donc un changement d’habitudes de vie pour maintenir des comportements alimentaires qui sont plus favorables à la réduction de l’inflammation.
Vous dites que le microbiote est déterminé à 4-5 ans ; peut-il déjà être en dysbiose si jeune ?
Le microbiote se détermine en fait de 0 à 2 ans. Il y a une grande différence entre un enfant qui est né par voie vaginale et un autre né par césarienne. Par voie vaginale, la mère lui transmet son microbiote à elle, par des bactéries vaginales et fécales, pendant l’accouchement. Ce sont ces premières bactéries qui vont coloniser le tube digestif de l’enfant. Par césarienne, les premières bactéries qui vont coloniser son tube digestif sont celles de l’environnement, du médecin et de la salle aseptisée. Donc, déjà là, on est capable dans certaines études de voir que l’accouchement vaginal est beaucoup plus protecteur de l’immunité du nouveau-né.
Ensuite, si l’enfant est nourri par le lait maternel, des prébiotiques et des probiotiques sont transmis naturellement. Ceux-ci favorisent un microbiote diversifié. Avec les formules lactées artificielles, on n’obtient pas autant de bons nutriments. Ces facteurs influencent ce qui va pousser dans le tube digestif. Puis, il y a les fameux antibiotiques qui embarquent, surtout les antibiotiques à large spectre, qui tuent les bactéries qui essaient de coloniser le tube digestif. La période 0-2 ans est donc une période critique. Après, il n’est pas trop tard pour faire quelque chose, mais ça veut dire que le microbiote de base est déjà un peu moins diversifié. La diversité est très importante. Plus tard, il faut partir de ce qu’on a et essayer de faire pousser ce qu’il y a de mieux pour notre microbiote.
Consommer un probiotique en supplément, est-ce une bonne idée ?
Le hic avec les probiotiques, c’est qu’ils ne viennent pas s’implanter dans le microbiote. Ils ont un effet vraiment temporaire. Pendant qu’on les consomme, ils peuvent avoir une influence positive, mais ils ne s’implanteront pas. Les probiotiques doivent donc être consommés régulièrement et à long terme si une certaine souche est bénéfique pour un individu.
Aussi, l’effet d’un probiotique varie d’une personne à l’autre, car on peut difficilement savoir quelle souche est bénéfique pour chaque individu. C’est là la limite des probiotiques. Les prébiotiques, par contre, ont plusieurs effets intéressants. Ils sont la nourriture des probiotiques. En arrivant dans l’intestin, ils stimulent les bactéries qui se nourrissent d’eux. Ils vont donc promouvoir un microbiote en santé. C’est comme de l’engrais pour les bonnes bactéries. Par exemple, on retrouve l’inuline, qui est un prébiotique, de façon naturelle dans certains aliments, comme la banane, l’artichaut, l’ail, le topinambour et l’oignon.
De façon générale, une alimentation riche en fruits et légumes est nécessairement riche en prébiotiques. Des chercheurs de l’Université Laval ont démontré, par exemple, que la canneberge est riche en polyphénols, qui ont un effet prébiotique sur les bactéries. Donc, faut-il vraiment prendre des suppléments de prébiotiques ? Moi, je suis plutôt pour une alimentation variée et de qualité. Si on a une alimentation riche en grains entiers, en fruits et en légumes variés, on obtient nécessairement les prébiotiques qui viennent avec ces aliments.
Que pensez-vous du régime anti-inflammatoire mis de l’avant par Jacqueline Lagacé, auteure de l’ouvrage Comment j’ai vaincu la douleur et l’inflammation chronique par l’alimentation?
Avec son régime hypotoxique, Jacqueline Lagacé a très bien expliqué et documenté les mécanismes liés à l’inflammation chronique. Il faut lui donner ce qui lui revient. Là où moi, j’ai une réserve, c’est que, premièrement, ce n’est pas une panacée. D’ailleurs, le Conseil national de l’ordre des médecins a fait une mise en garde par rapport à ce régime, dont l’efficacité thérapeutique n’est pas reconnue par la communauté scientifique. Ce régime ne remplace en aucun cas les traitements médicaux, contrairement à ce qui était parfois proposé.
Lorsqu’on analyse ce régime, on constate que c’est une alimentation de type ancestral basée sur la diète paléo, qui élimine plusieurs aliments, dont les produits laitiers, la majorité des céréales et tous les aliments cuits à haute température, etc. Aussi, aucun aliment transformé n’est permis, donc on élimine par le fait même les sucres et les gras raffinés.
Beaucoup de patients ont des effets positifs avec ce régime, on ne se le cachera pas. Toutefois, est-ce que c’est le fait d’avoir éliminé toutes traces de produits laitiers, toutes traces de blé dans l’alimentation qui apporte des effets positifs, ou c’est simplement le fait d’avoir éliminé les aliments transformés ? Parce que la plupart des patients qui commencent ce genre de régime éliminent beaucoup de choses. Il est donc impossible de savoir quel changement a réellement eu un effet favorable. À mon avis, ce régime est beaucoup trop restrictif pour rien et le simple fait d’éliminer les aliments transformés joue probablement un rôle majeur dans les effets positifs rapportés.
Si quelqu’un veut tout de même éliminer les produits laitiers, je n’ai rien contre ça. À mon avis, les produits laitiers ne sont pas essentiels dans l’alimentation. Par contre, des nutriments dans ceux-ci le sont, comme le calcium, la vitamine D et la B12. Quelqu’un peut décider de faire un test et éliminer les produits laitiers de son alimentation, du moment qu’il compense par des substituts végétaux enrichis, entre autres pour éviter un déficit en vitamine D, car celle-ci a des propriétés anti-inflammatoires.
En ce qui concerne l’alimentation sans gluten, elle peut avoir des effets néfastes sur le microbiote et elle n’est pas recommandée à moins d’avoir une maladie cœliaque. Une alimentation sans gluten, si on ne fait pas attention, sera déficiente en fibres, car elle demande d’éliminer plusieurs grains entiers. Donc, à l’exception de ceux qui mangent régulièrement du teff ou du quinoa, qui sont des céréales moins populaires, la plupart des gens qui mangent sans gluten consomment beaucoup de produits à base de maïs, de riz, et de pommes de terre, donc des produits qui ont très peu de fibres. Du point de vue du microbiote, une alimentation sans gluten n’a donc pas d’effets favorables. Et du point de vue de l’inflammation, rien n’a démontré que le gluten pouvait causer de l’inflammation chez des gens qui n’ont pas de prédisposition génétique ou une intolérance au gluten.
Par ailleurs, aucune étude clinique n’a démontré les effets bénéfiques propres à la diète hypotoxique. Quand on fait une revue de la littérature de toutes les maladies inflammatoires, ce sont les aliments transformés, les gras saturés et les aliments raffinés qui sont pointés du doigt. Cette diète-là, par la bande, enlève tout ça. La seule façon de vérifier les effets de la diète hypotoxique serait de comparer des gens qui éliminent tous les aliments transformés, donc qui adoptent une diète méditerranéenne par exemple, avec des personnes qui suivent toutes les restrictions imposées par la diète hypotoxique. Présentement, aucune étude en ce sens n’a été faite.
Aussi, ce qui me déplaît avec ce genre de diète, c’est que cela crée de l’anxiété liée à l’alimentation. S’alimenter devient compliqué, et il ne faut pas négliger l’aspect psychologique relié au microbiote et aux maladies. De telles restrictions dénaturent l’alimentation. Je ne pense pas que cette diète procure des avantages supérieurs à la diète méditerranéenne, qui elle a des effets bénéfiques démontrés par une multitude d’études. Nous connaissons donc une diète qui existe depuis plus de cent ans, avec des bénéfices prouvés, mais l’humain est toujours à la recherche de diètes miracles.
Le régime méditerranéen, c’est cuisiner soi-même des aliments frais, manger beaucoup de végétaux et du poisson au moins deux fois par semaine. Mais c’est aussi le plaisir de manger, de cuisiner, de partager les repas en famille ou avec des amis, et de bouger. C’est vraiment un mode de vie complet, qui a une incidence positive sur le stress, qui peut être un déclencheur d’inflammation chronique. De toute évidence, le stress a un effet fulgurant sur le microbiote. Cela pourrait faire l’objet d’un autre article !
Est-ce que certains aliments peuvent aggraver une pathologie inflammatoire ?
C’est sûr que dans l’exemple des maladies inflammatoires de l’intestin, ce sur quoi je travaille le plus, il y a deux choses : l’inflammation chronique (systémique) et l’inflammation locale. Par exemple, un intestin en inflammation aiguë (locale) pourrait mal réagir à la consommation d’un aliment très riche en fibres, mais sans que l’aliment soit la cause de l’inflammation. Pour l’inflammation systémique, c’est très difficile de dire si un aliment à lui seul peut augmenter l’inflammation. C’est la qualité globale de l’alimentation qui a un effet. Et en général, l’inflammation est causée par plusieurs facteurs. À moins que quelqu’un se mette à manger du fast-food pendant une semaine, ce qui pourrait accentuer la maladie inflammatoire, je ne pense pas qu’une telle aggravation puisse se faire en un seul repas, ou en consommant un aliment en particulier. C’est plutôt un schéma alimentaire sur une certaine période qui influence le tout.
Quelle est la principale limite de l’alimentation comme médecine ?
Une limite fondamentale de l’alimentation comme médecine, c’est qu’on aimerait bien savoir précisément quel aliment manger, quel aliment ne pas manger pour telle maladie – ce qui n’est pas possible à l’heure actuelle. En médecine, on fait beaucoup d’études cliniques et des méta-analyses, et si plusieurs études et méta-analyses disent la même chose, on établit des lignes directrices de pratique. En nutrition, c’est très difficile d’obtenir ça, en raison de ce que j’ai expliqué plus tôt. On n’a donc pas de méta-analyse sur les aliments en particulier, mais on peut toutefois en avoir sur des modèles alimentaires, comme la diète méditerranéenne, la diète nord-américaine ou la diète végétarienne. C’est pour ça que je m’intéresse à la diète méditerranéenne, puisqu’elle a été abondamment étudiée.
Dans l’idée que les besoins nutritionnels sont propres à chaque individu, de quelle façon la nutrition pourrait-elle faire partie des mesures proposées lors de la prise en charge d’un patient par un médecin ?
En ce moment, la limite est que nous n’avons pas le portrait génétique d’un patient donné. L’effet des aliments peut varier d’un individu à l’autre selon les gènes. Je pense que bientôt, pour certaines maladies ou certains gènes, on sera capable de faire des recommandations nutritionnelles personnalisées pour un patient donné. Les tests génétiques en nutrigénomique commencent à voir le jour et sont une avenue prometteuse pour le futur.
Dans 15-20 ans, oui, on sera rendu là. Présentement, nous n’avons pas ça. Quand on voit un patient pour un problème de santé, on doit, la plupart du temps, se fier aux recommandations générales, et celles-ci ont des limites. Avec l’avancée de la science, on y arrivera à un moment donné. Les médecins manquent de connaissances à jour en nutrition, car c’est une science qui évolue rapidement. C’est la raison pour laquelle ils dirigent souvent leurs patients vers des nutritionnistes, car leur champ d’expertise en nutrition est parfois limité.
À quelle source le public peut-il se fier dans ce dossier ?
On est à une époque où Internet regorge d’informations. C’est très difficile, même pour un professionnel de la santé, de s’y retrouver pour en extraire une information fiable.
La meilleure source que je peux recommander, c’est que la personne atteinte d’une pathologie X, par exemple une arthrite inflammatoire, se réfère à un site officiel. Ces organismes ont toujours des professionnels de la santé qui mettent les informations diffusées à jour. L’information sur ces sites est donc fiable. Si ce n’est pas écrit sur le site officiel, probablement que ce n’est pas une information vérifiée. Si cela ne fait pas partie des recommandations officielles, ce n’est sûrement pas solide. Par exemple, je dirige toujours les gens qui ont une maladie cœliaque vers la Fondation québécoise de la maladie cœliaque.
Au point de vue de la nutrition, si on veut consulter une nutritionniste spécialisée dans un domaine, on peut aller sur le site de l’OPDQ (Ordre professionnel des diététistes du Québec). On peut y faire une recherche par pathologie et trouver une nutritionniste spécialisée dans ce domaine.