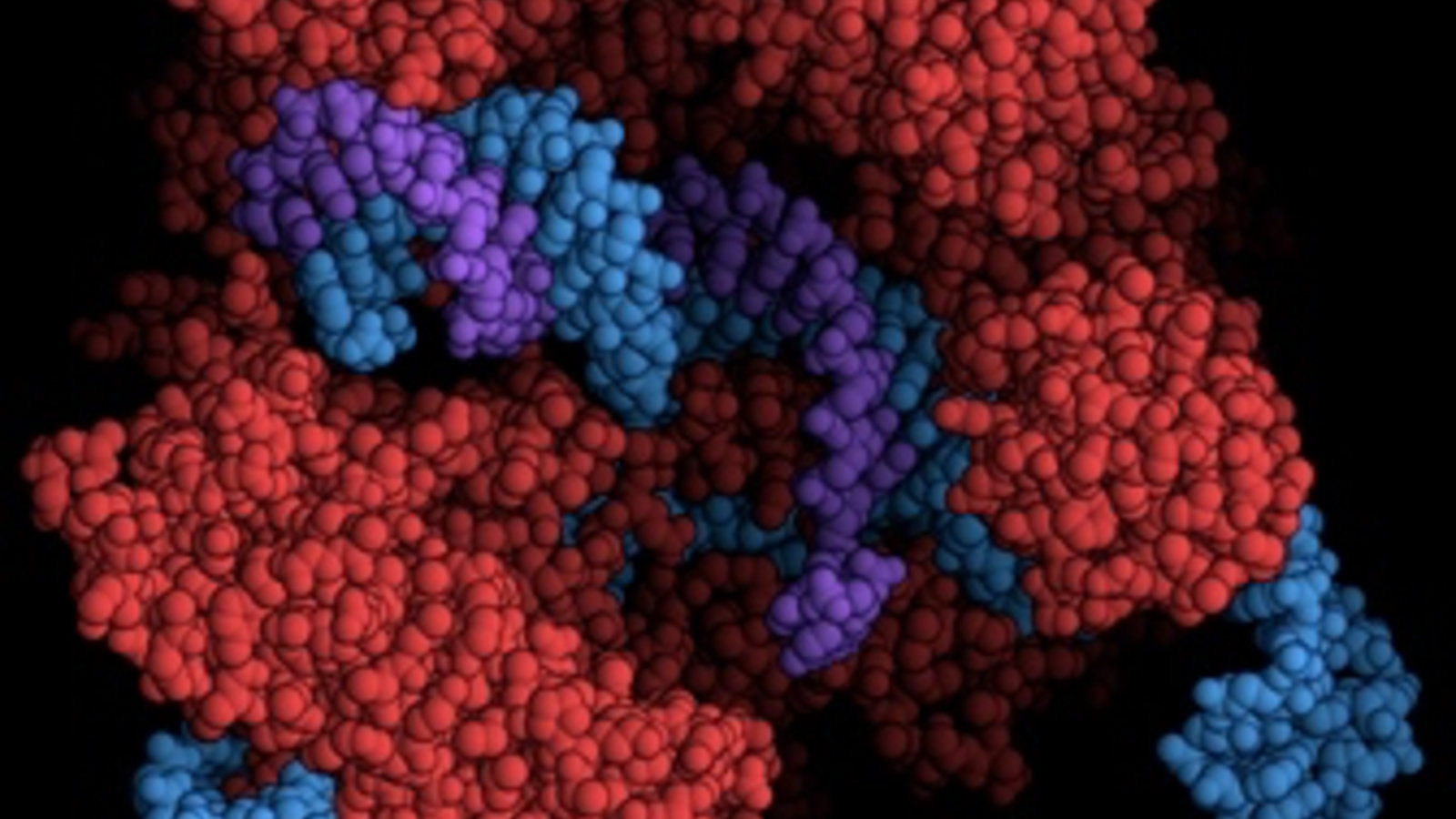
CRISPR, c’est un ensemble de molécules, un nouveau «bio-outil» qui ouvre la possibilité de modifier les gènes d’une plante, d’un animal ou d’un humain, avec une précision inégalée. Y compris des gènes d’embryons. Tous y voient un potentiel pour guérir des maladies héréditaires, encore que personne ne se soit risqué à donner un calendrier.
Abonnez-vous à notre infolettre!
Pour ne rien rater de l'actualité scientifique et tout savoir sur nos efforts pour lutter contre les fausses nouvelles et la désinformation!
Et comme le résume un reportage dans la dernière édition de Nature : «au contraire des autres méthodes d’édition de gènes, c’est peu coûteux, ça se fait vite et c’est facile à utiliser». D’où le fait que ça se soit répandu à travers le monde en moins de quatre ans, dans des laboratoires universitaires et privés, y compris certains qui ont déjà un pied dans le génie génétique en agriculture.
Mais c’est cette rapidité qui divise la communauté scientifique. Lorsqu’en avril, des chercheurs ont annoncé officiellement qu’une première expérience de manipulation génétique sur un embryon humain avait été tentée (sans succès), la sonnette d’alarme —sur laquelle certains tiraient depuis quelques mois— est soudain devenue audible: comment encadrer ces recherches? Comment éviter les dérapages? Ces modifications génétiques seraient-elles transmissibles à la génération suivante? Que sait-on des risques d’erreurs ou d’effets secondaires? Le reportage de Nature tape sur ce clou:
Plusieurs scientifiques mettent en garde contre le fait qu’il y a beaucoup à faire avant que CRISPR ne puisse être déployé de manière sécuritaire. Les scientifiques doivent accroître l’efficacité de l’édition, mais en même temps s’assurer qu’ils n’introduisent pas des changements ailleurs dans le génome qui auront des conséquences sur la santé. «Ces enzymes vont couper en des endroits autres que ceux pour lesquels elles ont été conçues, et ça a des conséquences.»
Car bien que peu de résultats aient encore été vérifiés et contre-vérifiés, les annonces prometteuses surgissent de partout. Rien que depuis le début de juin:
- des chercheurs de l’Université de Georgie ont annoncé «le premier usage réussi» de CRISPR/Cas9 pour faire de l’édition de gènes sur des arbres;
- une équipe du Laboratoire Jackson, dans le Maine, a décrit une nouvelle technique pour «livrer» par courant électrique la molécule CRISPR/Cas9 chez des souris;
- une équipe de l’Université de Tel-Aviv a annoncé une percée sur le front de la résistance des bactéries aux antibiotiques.
La biochimiste Jennifer Doudna, qui a été parmi les premières à démontrer la faisabilité de la technique en 2012 —et pour qui le Nobel a même été évoqué— tenait à jour, jusqu’à récemment, une liste des organismes vivants sur lesquels CRISPR/Cas9 a été testé. Il y en avait près d’une quarantaine en mai, mais leur nombre est voué à augmenter très vite cet été.
A quoi pourrait ressembler un dérapage? L’anecdote provient de Jennifer Doudna: un étudiant au post-doctorat qui, en 2014, a présenté dans un congrès —les résultats ont été ensuite publiés dans Nature — une expérience au cours de laquelle un virus a été transformé pour transporter la molécule CRISPR chez une souris souffrant d’un cancer du poumon. C’est l’inhalation de ce virus par la souris qui a suffi à ce que CRISPR subisse la mutation que l’étudiant voulait tester. Or, comme le cancer en question était un modèle du cancer du poumon humain, on était du coup en train de créer une version de CRISPR qui aurait pu aussi fonctionner dans un poumon humain. Un pas dangereux, considérant qu’aucune étude préliminaire n’a été menée à ce sujet. Les premiers essais cliniques ne sont encore, dans les scénarios les plus optimistes, qu’à un ou deux ans dans le futur.